导读
国家药监局评审中心近日于《中国食品药品监管》上发表新文章,对我国先进治疗药品的范畴与分类进行了深入探讨,其中提出细胞产品有望成为先进治疗药品的一部分。

以细胞和基因治疗产品为典范的先进治疗药品(ATMP),为攻克癌症、遗传病及罕见病等医学难题提供了新的治疗途径和选择。
据Citeline数据库的最新统计,截至2024年4月,全球范围内已有超过100种基因、细胞与RNA产品获得市场准入,同时,还有3700余种产品(其中基因治疗产品约占55%,细胞治疗产品约占53%)正处于临床前或临床开发阶段(临床阶段约占30%)。
尽管我国的先进治疗产业相较于其他国家起步较晚,但现已迅速崛起,成为全球细胞疗法研发最为活跃的区域。根据ClinicalTrials.gov的不完全统计,我国在细胞治疗临床试验的数量及产品申报数量上,已位列世界第二,仅次于美国。
自2021年我国首个嵌合抗原受体T细胞(CAR-T)治疗药品获得批准以来,国内上市的CAR-T产品数量已占据全球同类产品的半壁江山。这标志着我国先进治疗产业的发展已跻身国际先进行列。
全球监管体系的建立
及中国监管体系的发展
随着全球多个国家和地区不断加强ATMP监管体系的顶层设计与能力建设,如美国FDA、欧洲EMA及日本PMDA等药品监管机构,已逐步构建起ATMP的监管框架,并积极制定与发布相关法规指南,且不断完善。据初步统计,全球监管机构至今已公布超过400个与细胞及基因治疗产品相关的技术指南。部分国家甚至在法律法规中明确了这类药品的定义与分类,并通过激励政策(例如特殊审评程序)来加速产品的上市审批流程。
中国国家药品监督管理局(NMPA)也已发布30余项相关技术指导原则,全面覆盖产品研发、注册、工业化生产以及上市后变更等各个环节。在我国,这类产品享受着鼓励创新、加速审评审批等多项优惠政策。然而,目前尚未在法律法规层面对该类药品进行明确的分类与定义,其名称与分类在行业内也尚未形成统一意见。这种名称使用与分类的不一致性,对规范监管、行业交流以及国际协调均造成了不利影响。
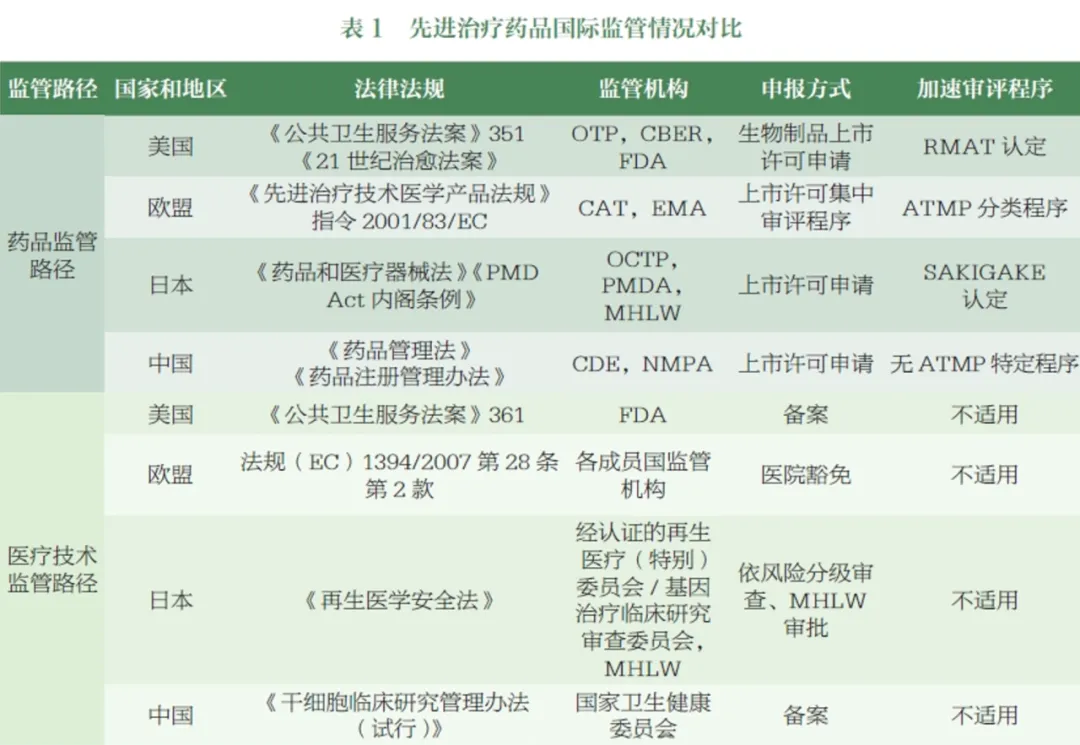
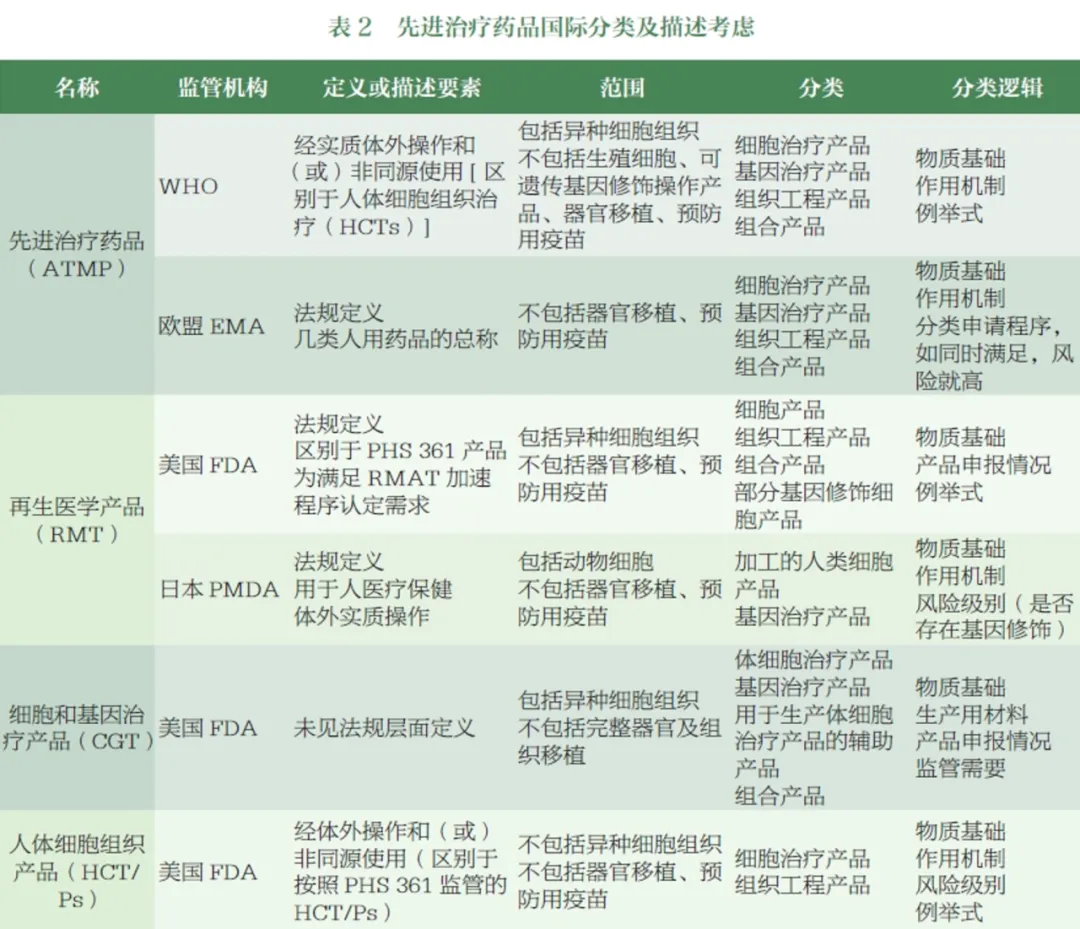
ATMP分类与定义的建议
结合对国外监管机构ATMP监管分类的调研成果,国家药品监督管理局药品审评中心(CDE)已组织相关部门对国内相关产品的申报状况进行了梳理,初步提出了我国ATMP的分类与描述,并召开了专家研讨会,本文提出了以下ATMP分类与定义的建议:
名称与描述:建议采用“先进治疗药品”作为ATMP的中文名称,英文名称为“ATMP”。描述方面,应涵盖物质基础、工艺特点、功能用途等要素,明确ATMP是指经体外操作生产并在体内发挥作用的细胞治疗药品、基因治疗药品或组织工程药品等。
分类建议:将ATMP分为细胞治疗药品、基因治疗药品和其他类。其中,细胞治疗药品可进一步细分为非基因修饰细胞治疗药品和基因修饰细胞治疗药品;基因治疗药品的描述和亚类划分可参照国际监管机构的相关标准;其他类则包括一些创新性强、研发成熟度相对较低的产品,如肿瘤新生抗原产品、细胞衍生物等。
总结
ATMP作为生物医药领域最具潜力和前景的发展方向之一,其监管体系的建设和完善至关重要。本文提出的ATMP分类与定义建议,旨在与国际主要监管机构分类体系相接轨,为后续监管分类相关的支持政策制定提供参考,并引导完善相应技术指南、标准体系及国际监管协调。未来,随着监管政策的不断完善和科技创新的驱动,中国先进治疗产业将迎来更加广阔的发展前景。
信息来源:中国食品药品监管杂志公众号
 鲁公网安备37010002000272号
鲁公网安备37010002000272号