中检院:细胞治疗是医药领域的一场深刻变革
导 语
细胞治疗作为生物医学领域的前沿热点,其快速的创新发展不仅关乎公众健康,更深刻影响国家的生物安全。欧美、日本等发达国家已将此提升至国家战略高度,并构建了完善的药品监管体系以巩固其在细胞治疗领域的领先地位。

2024年8月,中国食品药品检定研究院(简称中检院)、中国药学会、南京医科大学附属苏州科技城医院的团队在行业期刊《中国药物评价》上发表了题为《国际细胞治疗临床研究发展现状及监管政策研究》的报告。该报告全面梳理了全球主要国家及地区和我国的细胞治疗临床研究现状,旨在为我国相关机构、企业及从业人员提供有价值的参考。中检院团队的报告开篇指出,创新是驱动生物医药产业迈向新质生产力发展的核心引擎。细胞和基因治疗领域,不仅是技术进步的显著标志,更是医药领域的一场深刻变革。作为创新医疗技术的典范——细胞治疗产品及技术,自1990年Thomas 医生因骨髓移植研究荣获诺贝尔奖以来,已逐步从实验室步入临床应用阶段,为患者带来治疗的新希望。尽管全球范围内对细胞治疗的定义尚未统一,但这并不妨碍它的迅猛发展,其定义因涉及的治疗类型、目标疾病以及应用技术的多样性而呈现差异。我国监管部门将细胞治疗产品定义为用于治疗人的疾病,来源、操作和临床试验过程符合伦理要求,按照药品管理相关法规进行研发和注册申报的人体来源的活细胞产品。
01
干细胞和免疫细胞治疗
细胞治疗的种类繁多,根据细胞来源可划分为干细胞治疗和免疫细胞治疗等类别,根据供体来源不同分为自体、同种异体和异种细胞等。作为生命科学研究前沿应用技术,细胞治疗在恶性肿瘤、遗传性疾病及慢性退行性疾病等领域显示出巨大的治疗潜力。多款细胞治疗产品已成功上市,并显示出优异疗效,其中干细胞疗法以其较长的应用历史和活跃的研究态势显得尤为突出。骨髓/造血干细胞疗法是最早的干细胞疗法,主要用于骨髓/造血干细胞移植,以治疗白血病等血液系统恶性肿瘤。人源性干细胞及其衍生治疗产品作为重要的再生医学产品,在细胞替代、组织修复、疾病治疗等方面具有巨大潜力。免疫细胞疗法,是利用免疫细胞进行疾病治疗的一种方法,最早主要应用于治疗恶性肿瘤。1986年,美国科学家Ronsenberg发明的淋巴因子激活的杀伤(LAK)细胞,是最早具有广泛临床应用价值的免疫细胞疗法。根据免疫细胞治疗的特异性,通常可分为特异性免疫细胞治疗和非特异性免疫细胞治疗。特异性免疫细胞治疗包括嵌合抗原受体T细胞治疗(CAR-T)、T细胞受体嵌合T细胞治疗(TCR-T)、嵌合抗原受体自然杀伤细胞治疗(CAR-NK)、树突状细胞与细胞因子诱导的杀伤细胞联合治疗(DC-CIK)。非特异性免疫细胞治疗主要包括淋巴因子激活的杀伤细胞治疗(LAK)及细胞因子诱导的杀伤细胞治疗(CIK)。此外,细胞外囊泡作为细胞衍生物,具有比活细胞更容易表征、储存、包装和运输的非生命性质优势,其研究已呈现爆发式增长。细胞外囊泡(EV)是细胞释放到细胞外空间的脂质双层膜性小泡的总称,其直径范围为50~2000纳米。其中外泌体(exosomes)为直径为30-150纳米的细胞外囊泡。目前,FDA至少已批准8个外泌体产品进入临床Ⅱ期/Ⅲ期试验。其中,Direct Biologics公司研制的ExoFlo(骨髓间充质干细胞来源EV)已经进入临床Ⅲ期试验。
02
大量资本进入细胞治疗领域
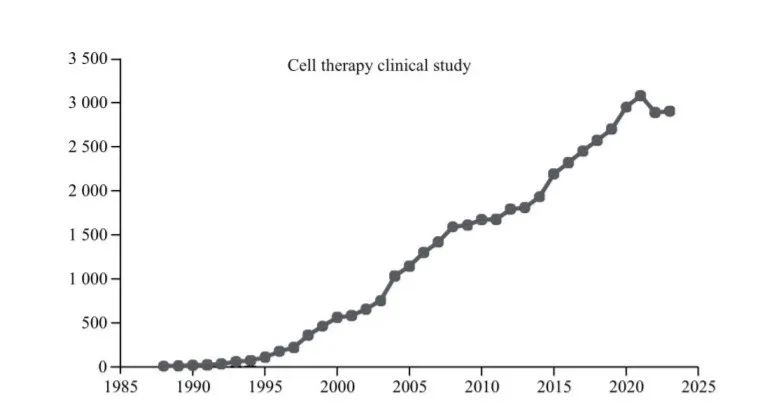
由于慢性病发病率上升、老年人口增加以及该领域的技术进步,全球细胞疗法市场预计将大幅增长。根据Technavio 预计,2023~2027年全球细胞治疗市场份额将增加到310.4亿美元,复合年增长率为57.06%。2015 年以来,随着细胞治疗药物的陆续获批上市,大量资本进入细胞治疗研发领域成为细胞治疗行业加速发展的推动力。其中,2023年我国细胞治疗研发融资事件数量为 47件,在所有药物研发融资事件数量中居于首位。中检院的报告统计了过去20多年间全球细胞治疗临床研究数量增长趋势。截至2023年底,全球在美国临床试验注册库 clinicaltrials.gov 平台上登记的细胞治疗相关临床研究项目已超过45000项,其中2021年新增总量已经超过3000项,2022年及2023年受疫情影响,项目数量略有下降,但仍年均超过了2800项(图1)。
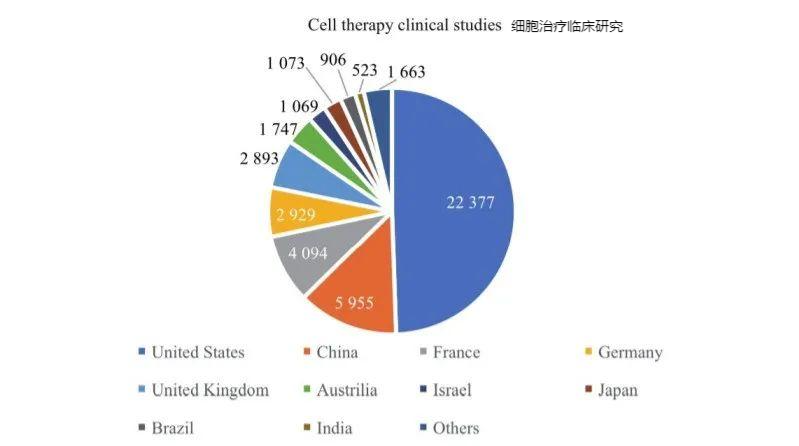
全球细胞治疗研发集地域主要为北美(主要是美国)、东亚以及西欧。对美国、中国、法国、德国、英国、澳大利亚、以色列、日本、巴西、印度等国家或地区开展的各类细胞治疗临床研究进行了统计,美国和中国在全球细胞治疗研发方面占据主导地位,适应证主要集中在肿瘤领域,并逐步向非肿瘤领域扩展。其中,美国开展细胞治疗临床研究约占全球1/2,超过22300项,中国接近全球1/7,全球排名第二,约6000项(图2)。
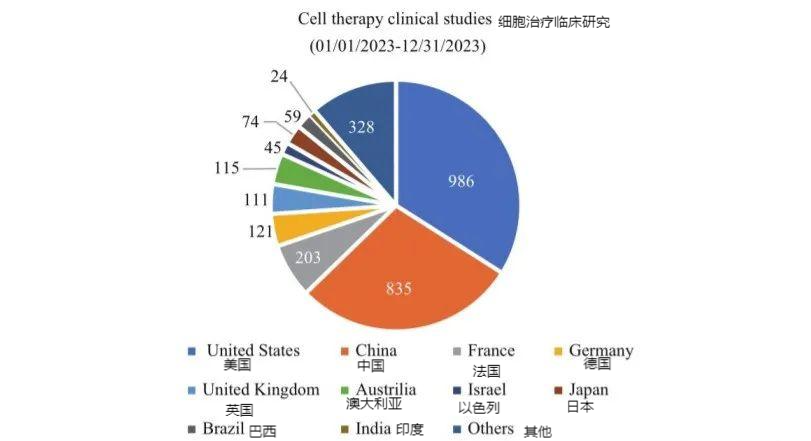
随着我国生物医药健康产业提升成为国家战略,细胞治疗临床研究数量不断上升,已经跻身全球第一梯队。2023年度全球细胞治疗临床研究2900余项,我国细胞治疗临床研究超过800项,约占全球数量30%,与美国(980余项)接近(图3)。
干细胞临床研究与全部细胞临床研究情况类似,2023年度全球干细胞治疗临床研究约560项,我国细胞治疗临床研究超过130项,美国为约 160项。申报的适应证以肿瘤、心血管疾病、骨骼肌肉类疾病等慢性病为主。在具体领域技术方面,我国细胞治疗研发水平与发达国家相比基本处于并驾齐驱阶段,甚至在某些领域已经跃居国际前沿。我国在新兴的 TCR-T 及 TIL等免疫细胞治疗临床研究数量方面已经持平或超过美国。2023 年度,全球TCR-T 临床研究共 15 项,我国有 11 项,美国为4 项;全球TIL 临床研究共74 项,我国有 20 项,美国 22 项。这些数据充分展示了我国在细胞治疗领域,特别是免疫细胞治疗方面的强劲发展势头和显著成就。
中国关于细胞治疗主要规范指南

在政产学研用等各方共同努力下,我国的细胞治疗研发及监管水平基本与国际同步。特别是2017年以来,国家药监局药审中心(CDE)陆续发布30多项细胞及基因治疗相关技术指南,形成了从研发、注册、生产到上市后全生命周期的监管体系,为我国细胞治疗成果转化及产业规范发展提供了监管政策保障。
 鲁公网安备37010002000272号
鲁公网安备37010002000272号